血管紧张素转化酶2与冠状病毒的"不解之缘":感染与致病机制进展
血管紧张素转化酶2与冠状病毒的"不解之缘":感染与致病机制进展
侯攀 徐强 那剑 张必利 吴弘 李攀 赵仙先
中华心血管病杂志, 2020,48:网络预发表. DOI: 10.3760/cma.j.cn112148-20200224-00121
摘要
与严重急性呼吸系统综合征冠状病毒(SARS-CoV)一样,2019新型冠状病毒(2019-nCoV)亦是以血管紧张素转化酶2(ACE2)为受体感染细胞。ACE2作为肾素-血管紧张素系统(RAS)的重要成员,与ACE互为拮抗,二者的平衡与失衡在维护心血管系统生理功能、机体炎症反应、肺损伤等过程中均发挥着重要作用,而其在冠状病毒感染与致病机制中亦发挥着非常重要的作用。目前为止,在7种人畜共患的冠状病毒中有3种以ACE2为受体感染细胞,即SARS-CoV、人类冠状病毒NL63(HCoV-NL63)和2019-nCoV,了解这些病毒与ACE2的相互作用对于冠状病毒感染的预防和治疗意义重大。本文对相关文献进行了梳理,总结了ACE2及RAS系统在冠状病毒感染、致病过程中发挥的作用,对于2019-nCoV防治过程中存在的争议进行了归纳,针对ACE2和RAS系统中可能存在的2019-nCoV的治疗靶点进行了展望。
引用本文: 侯攀, 徐强, 那剑, 等. 血管紧张素转化酶2与冠状病毒的"不解之缘":感染与致病机制进展 [J/OL] . 中华心血管病杂志,2020,48 (2020-03-11).http://rs.yiigle.com/yufabiao/1184403.htm. DOI: 10.3760/cma.j.cn112148-20200224-00121.[网络预发表].
参考文献导出: Endnote NoteExpress RefWorks NoteFirst 医学文献王
2019年12月,中国湖北省武汉市暴发不明原因肺炎。病原体很快被确定为一种新型的冠状病毒——2019新型冠状病毒(2019 novel coronavirus,2019-nCoV),所致疾病即为新型冠状病毒肺炎(COVID-19)。据中华人民共和国国家卫生健康委员会卫生应急办公室报道,截至2020年2月19日24时,我国31个省(自治区、直辖市)和新疆生产建设兵团COVID-19累计确诊病例已达74 576例,死亡2 118例[1],对我国的经济、社会、民生均造成重大影响。业已经证明,与2003年引发严重急性呼吸系统综合征(severe acute respiratory syndrome,SARS)的严重急性呼吸系统综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)一样,2019-nCoV也是以血管紧张素转换酶2(angiotensin converting enzyme 2, ACE2)为受体感染细胞的。ACE2作为肾素-血管紧张素系统(renin-angiotensin system, RAS)的重要成员,广泛分布于人体各组织,通过与血管紧张素转换酶(angiotensin converting enzyme, ACE)的拮抗制衡,在维持心血管系统正常生理功能中发挥重要作用,其也被证明参与了冠状病毒的感染和致病过程。认识冠状病毒,并了解ACE2在其感染和致病过程中发挥的作用和特点,对于掌握病毒传播和致病特点、指导临床工作以及药物开发均具有重要意义。
一、冠状病毒概述
冠状病毒为单股正链非节段RNA病毒,属于套式病毒目下的冠状病毒科、冠状病毒属。其基因组大小为27 000~32 000 bp,是已知的所有RNA病毒中最大的[2]。在结构上,核衣壳蛋白包裹核酸形成螺旋衣壳,是此类病毒的遗传核心。核衣壳外为病毒包膜,包膜上有3种结构蛋白,即参与病毒组装的膜蛋白M和包膜蛋白E,以及介导病毒进入宿主细胞的刺突蛋白S,部分冠状病毒还编码血凝素酯酶蛋白。由于刺突蛋白在病毒表面形成较大的突起使得病毒整体结构呈冠状,因此得名。根据血清型和基因组特点,冠状病毒被分为α、β、γ和δ4属。目前已知的冠状病毒大约有15种,其中可感染人类的7种冠状病毒均来源于α和β属。在这7种冠状病毒中,α属的229E、NL63和β属中的OC43通常仅导致成人的普通感冒,儿童较敏感,可致上呼吸道感染;而同属于β属的HKU1则可以导致人类肺炎[3]。在过去的近20年里,β属中SARS-CoV、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)相继在世界范围内引起了疾病大暴发,被密切关注。2002年至2003年SARS疫情中,全球共报告病例8 096例,其中死亡774例,致死率达9.6%,蔓延至29个国家和地区[4]。近10年后,自2012年4月至2018年10月,中东呼吸综合征(Middle East respiratory syndrome,MERS)暴发,在全球范围内经实验室确诊患者2 229例,死亡791例,病死率高达35.5%,6年期间共计影响了27个国家,且并无完全终止的迹象[5]。此次引发COVID-19的病原体2019-nCoV是能够感染人类的第7种冠状病毒,该病毒传播力较SARS-CoV强,目前粗致死率约为2.8%[1],虽不及SARS和MERS高,但传播十分迅速,全世界多个国家和地区均已受到影响。
二、ACE2与RAS概述
RAS是人体体液调节系统的重要组成成分,主要参与调节心血管系统的正常生理功能。该系统异常与高血压、心肌肥厚、心力衰竭、肺损伤等的发生发展关系密切。在RAS中,由肾脏产生的肾素以肝脏产生的血管紧张素原(angiotensin,Ang)为底物生成血管紧张素Ⅰ(angiotensinⅠ,AngⅠ),当AngⅠ流经肺部血管时,在ACE的作用下生成活性物质血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)。AngⅡ有血管紧张素Ⅱ1型受体(angiotensin Ⅱ type 1 receptor, AT1R)和血管紧张素Ⅱ2型受体(angiotensin Ⅱ type 2 receptor, AT2R)两种受体,AT1R在人体组织中表达广泛,AT2R在胎儿时期高表达,出生后表达迅速下降。生理状态下,AT1R与AT2R的拮抗作用构成了RAS系统的一对平衡作用力,AngⅡ与AT1R结合可促进儿茶酚胺类物质的释放,收缩血管,发挥促炎、促进机体氧化应激反应及组织纤维化等作用[6,7],与AT2R结合则发挥相反作用,如舒张血管、抗增殖、抗炎以及抗纤维化等[8]。
ACE2作为RAS的另一重要角色,在2000年被科学家发现。2003年SARS暴发后,又作为SARS-CoV感染细胞的受体备受关注。ACE2是一种金属蛋白酶,具有单羧基肽酶活性,能够将AngⅡ水解为Ang1-7,也能将AngⅠ水解为Ang1-9。Ang1-9同样可在ACE或其他肽酶作用下继续水解生成Ang1-7。进一步研究发现,ACE2对AngⅡ的水解活性比AngI高至少400倍[9,10]。Ang1-7作为主要产物,通过与Mas受体结合,发挥与ACE-AngⅡ-AT1R轴相反的作用,如舒张血管、抑制增殖、抗血栓形成、抗炎和抗纤维化等[11]。而在RAS之外,ACE2作为一种蛋白酶,还可以水解Apelin-13和Des-Arg缓激肽,前者影响Apelin-13的降压作用,后者则抑制Des-Arg缓激肽与受体结合,阻止炎症反应的进行[12,13]。ACE2在人体组织中广泛分布,且树突状细胞、单核巨噬细胞、淋巴细胞等炎症免疫细胞均拥有独立的RAS[8]。以ACE-AngⅡ-AT1R轴和ACE2-Ang1-7-Mas轴的拮抗作用为核心,ACE2在心血管系统疾病、肺损伤、免疫系统疾病乃至神经系统疾病中均发挥着重要作用[14,15,16]。
ACE2组织分布、RAS全貌及冠状病毒感染细胞过程的示意见图1。

图1血管紧张素转化酶2组织分布、肾素-血管紧张素系统全貌及冠状病毒感染细胞过程的示意图
三、ACE2在冠状病毒感染与致病中的作用
冠状病毒感染细胞依赖于其表面的刺突蛋白(spike glycoprotein, S蛋白)。病毒感染细胞时,S蛋白可被水解为S1和S2片段,S1负责特异性识别并结合细胞表面的特定受体,S2则介导病毒包膜与细胞膜的融合。S蛋白决定了病毒的物种选择性和组织嗜性[17]。目前已知的7种可感染人类的冠状病毒中,有3种是通过ACE2感染细胞的,即SARS-CoV、人类冠状病毒NL63(HCoV-NL63)和2019-nCoV。通过S蛋白与ACE2结合,病毒完成侵入过程,进入复制阶段,是其发挥致病作用的开端。
1.ACE2与SARS:
2005年,Kuba等[18]的实验证明ACE2蛋白是SARS-CoV进入细胞必不可少的环节,同时还发现在病毒感染过程中宿主细胞表面ACE2表达量减少,而ACE的表达未受影响。SARS-CoV的这种特性导致ACE/ACE2失衡,进而引发一系列的连锁反应[19]。Imai等[20]利用酸诱导的小鼠急性肺损伤模型验证了ACE2在肺损伤中的作用,结果显示ACE2基因敲除小鼠的肺损伤程度和死亡率均高于野生型小鼠;而在损伤后,给予重组ACE2蛋白或AT1R受体抑制剂进行治疗,则可减轻ACE2基因敲除小鼠肺损伤的程度。在肺损伤过程中,ACE和ACE2具有制衡作用。ACE将AngⅠ转化为AngⅡ,ACE2则将AngⅡ水解为Ang1-7。SARS-CoV感染降低ACE2的表达量,此时ACE-AngⅡ-AT1R轴的作用占居优势地位,在高浓度AngⅡ的作用下,肺部血管通透性增加,局部炎症反应激活,肺部开始出现水肿、渗出及炎症反应。
此外,ACE2还在SARS-CoV引起的炎症风暴中发挥重要作用。一方面,SARS-CoV引起炎症风暴是病毒入侵激活人体免疫系统所致。He等[21]对4例死于SARS的患者进行尸体解剖,病理结果显示在表达ACE2的细胞中,促炎细胞因子(pro-inflammatory cytokines, PIC)高表达,而在不表达ACE2的细胞中,则没有PIC的表达。这些PIC包括单核细胞趋化因子-1(MCP-1)、肿瘤生长因子-β1(TGF-β1)、肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β和IL-6等,则进一步引发多脏器的免疫介导损伤,成为炎症风暴的导火索。另一方面,ACE2降低造成Des-Arg缓激肽积累,Des-Arg缓激肽与BK1受体结合后可促进炎症因子释放同时募集中性粒细胞,加重肺部的炎症损伤。但同时也需要注意,SARS-CoV引起的炎症反应并不都是与ACE2相关的,病毒感染过程中多种炎症通路均参与了炎症风暴[22]。换言之,炎症风暴在多大程度上与ACE2相关尚无定论。
2.ACE2与HCoV-NL63:
HCoV-NL63属于冠状病毒的α属,虽然与SARS-CoV一样,以ACE2蛋白作为其侵入细胞的受体,但是致病力却与SARS-CoV有着天壤之别。HCoV-NL63更易感染小儿和免疫力低下的老年人,患者大部分表现为急性呼吸道感染,表现为发热、咳嗽、咽痛、鼻炎等普通感冒症状,部分患者也可以出现胃肠道症状,通常比较温和,但是在感染小儿、老年人时也可出现严重的下呼吸道症状[23]。
作为冠状病毒α属的成员,其基因序列与β属的SARS-CoV有很大不同。二者虽然同样是以ACE2作为入侵受体,但是与SARS-CoV相比,HCoV-NL63与ACE2的亲和力要弱得多。Dijkman等[24]通过体外实验证实,HCoV-NL63虽然在侵入过程中同样可以导致ACE2表达下降,但是这种作用依赖于病毒的复制效率,只有在34 ℃的特定条件下才能观察到;而在37 ℃的条件下,病毒对ACE2的影响非常微弱。换言之,在HCoV-NL63与ACE2结合效率低,病毒复制弱的情况下,其对ACE2表达的影响是非常有限的,这也在一定程度上解释了二者在致病性上的不同。Naskalska等[25]还证实HCoV-NL63的M蛋白在感染的早期阶段也是重要的角色,这两种蛋白(M和S)的协同作用是有效感染的前提。提示决定病毒入侵效率和致病程度的是一个复杂的体系,多种病毒蛋白的协同作用导致病毒传播力和致病能力不同,仅关注冠状病毒的S蛋白与ACE2的结合对于全面了解病毒的致病机制远远不够。
3.ACE2与2019-nCoV:
2019-nCoV同样是以ACE2作为受体侵入细胞。周鹏等[26]通过蛋白序列分析,发现2019-nCoV与SARS-CoV有7个保守的非结构蛋白氨基酸序列相似度为94.6%。计算机同源性建模显示,2019-nCoV与SARS-CoV具有类似的受体结合区域[27]。 Mclellan团队在此基础上,利用冷冻电镜技术从结构层面上推测2019-nCoV与ACE2结合的强度是SARS-CoV的10~20倍[28]。这解释了为什么2019-nCoV比SARS-CoV传播力更强。并且体外实验证实,表达ACE2的细胞会被感染,而如果细胞上没有表达ACE2则不会被感染[26]。由此推测ACE2的分布与病毒感染密切相关。韩泽广团队基于单细胞测序数据,发现人体器官中ACE2的表达量从高到低依次为回肠、心脏、肾脏、膀胱、食道、肺和气管。以肺泡二型细胞的ACE2表达量为1%,回肠上皮细胞和心肌细胞ACE2的阳性表达率分别为30%和7.5%[29]。但是在临床上,2019-nCoV感染以肺部损伤为主,这可能是由于该病毒主要通过呼吸道途径传播,肺组织暴露机会更多、暴露面积更大;另外以往对冠状病毒的研究发现,动物中存在持续肠道感染但却不表现任何症状的情况,虽然感染2019-nCoV较少表现出消化道症状,但是已经从粪便中发现了病毒颗粒,是否存在类似的机制尚有待进一步研究[30]。总之,应注意到除肺组织外,人体多种表达ACE2的组织器官都可能会受到2019-nCoV的攻击(图2)。此外,ACE2的编码基因位于Xp22.2,理论上女性ACE2的表达丰度更高。但Zhao等[31]通过生物信息学分析,指出肺中男性表达ACE2的细胞类型和细胞占比均高于女性,且ACE2的高表达伴随着病毒感染复制相关基因的高表达,提示男性可能对2019-nCoV更易感,且更易发生恶性进展。从临床数据上看,早期确诊的41例患者中30例为男性,中国疾病预防控制中心发布的72 314例患者的数据同样显示男性比例高于女性(51.4%比48.6%),且男性患者的粗病死率更高(2.8%比1.7%)[32,33]。
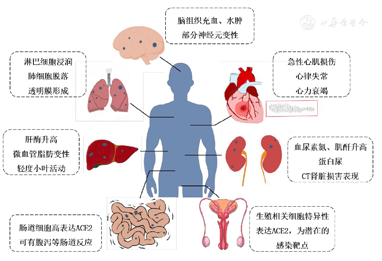
图22019新型冠状病毒感染可能引起的人体组织和器官损害
在致病机制上,刘映霞等[34]的研究发现COVID-19患者血浆AngⅡ的水平明显升高,且与病毒滴度及肺损伤程度线性相关。Huang等[32]测定了早期41例确诊患者血浆细胞因子和趋化因子,发现确诊患者血浆细胞因子和趋化因子水平高于健康人群,且重症患者血浆的IL-2、IL-7、IL-10、粒细胞集落刺激因子(G-SCF)、重组人干扰素诱导蛋白-10(IP-10)、MCP-1、巨噬细胞炎症蛋白-1A(MIP-1A)和TNF-α这些细胞因子水平进一步高于非重症患者。提示2019-nCoV很有可能与SARS-CoV一样通过降低ACE2的表达水平、破坏ACE/ACE2平衡发挥致病作用,同样也能引发细胞因子风暴,且细胞因子风暴与疾病严重程度相关。值得注意的是,SARS-CoV和2019-nCoV虽均可感染肠道,但是SARS-CoV的消化道症状常见,而2019-nCoV的消化道症状并不常见[35];并且与SARS相比,COVID-19多为轻症患者,不易发生严重细胞因子风暴,但重症患者却容易发生多脏器功能衰竭,病死率高于SARS重症患者[36]。提示二者虽均以ACE2为受体,但有所不同,2019-nCoV的致病性在多大程度上与ACE2相关,是否同时存在与ACE2无关的致病机制,以及ACE2在触发细胞因子风暴过程中发挥怎样的作用?均需进一步研究证实。
4.针对RAS的降压药物对冠状病毒感染与致病的影响:
针对RAS的降压药物主要包括血管紧张素酶抑制剂(angiotensin-converting-enzyme inhibitors, ACEI)和血管紧张素酶受体阻滞剂(angiotensin receptor blocker, ARB),前者主要通过抑制ACE的活性,降低AngⅡ浓度,发挥降压作用,后者则主要通过抑制AngⅡ与受体结合,达到降压效果。有研究显示在确诊患者中,合并高血压的比例为12.8%,为所有合并症中最高的[33]。唐春仕等[37]则发现原发性高血压患者的血浆ACE2水平明显高于健康人群。提示高血压患者可能更易感染2019-nCoV。一时间,广泛应用的RAS降压药物与冠状病毒感染和致病之间的关系引发了激烈地争论。首先,是RAS降压药物是否会对ACE2的表达造成影响,继而影响病毒易感性。动物实验发现在大鼠中应用ACEI或ARB可以提高ACE2的mRNA表达水平或增强其活性[38],但尚无研究显示此类药物对人体ACE2表达的影响,也没有相关流行病学证据提示2019-nCoV感染与此类降压药物相关。是否需要停用此类药物,一方面相关的研究亟需进行,另一方面从流行病防控的角度讲,面对传播力如此强大的2019-nCoV,易感只是个相对概念,相比于停药,接触防护和呼吸道防护更为重要。其次,对于已感染的患者而言,应用ACEI或ARB类药物是利是弊?一方面,ACEI类药物会造成缓激肽积累,缓激肽积累通过Des-Arg缓激肽-BK1受体途径,会加重炎症反应和肺损伤,因此部分医生建议停用ACEI类药物。另一方面,ACEI和ARB通过阻断ACE-AngⅡ-AT1R轴,使失衡的ACE和ACE2作用达到新的平衡点,同时大大降低了AngⅡ引起的肺损伤效应,部分医生认为应坚持使用RAS降压药物。这一争议归根结底是哪条通路在肺损伤过程中占主导地位的问题。前期的动物实验证实,与野生型小鼠相比,ACE基因完全敲除小鼠(ACE-/-)的肺损伤程度最轻,部分敲除小鼠(ACE+/-)次之,提示肺损伤程度与ACE作用水平呈正相关[20]。日前,又有临床数据提示AngⅡ与病毒滴度和肺损伤程度线性相关[34]。这些数据提示降低AngⅡ水平更为紧迫和重要。因此,更多的证据和推论指向应坚持使用不良反应较少的ARB类药物,而对于ACEI类药物目前尚缺乏相关的证据指导其在COVID-19中的应用,临床应用应谨慎,避免加重肺损伤,同时相关的临床和基础研究也亟需开展,以获得更多证据指导患者血压管理。
综上所述,结合实验室和临床数据,我们有理由相信ACE2的表达与人群分布影响病毒易感性。男性、高血压患者更易感染2019-nCoV且与预后相关。同时需要注意的是,2019-nCoV比SARS-CoV传播力更强,人群普遍易感。易感人群只是相对概念,在存在接触和暴露的前提下,任何人群受到感染的概率都极高。因此,从预防角度而言,切断传染源和传播途径更为重要。在致病机制上,2019-nCoV导致严重肺损伤和全身炎症风暴的机制尚缺乏直接证据,但是其与SARS-CoV高度同源且受体相同,二者很有可能致病机制相同,至少对RAS的影响应该是一致的。在发现确凿证据之前,有关SARS的防治思路或许有一定的参考价值。目前,对于COVID-19尚缺乏较好的治疗方案。鉴于ACE2在2019-nCoV感染和致病过程中的重要作用,相关靶点的药物研究或可为2019-nCoV的防治带来新的希望。海军军医大学团队通过将ACE2的胞外区连接到人免疫球蛋白IgG1的Fc区构建了一种新型重组蛋白,体外实验证明融合蛋白能有效中和SARS-CoV和2019-nCoV,在诊断、预防和治疗COVID-19中有较大的潜在价值[39]。在急性肺衰竭的临床试验中,使用重组rh-ACE2补充患者体内的ACE2也被证实能够有效减轻急性肺损伤[40],或许可以尝试用于2019-nCoV感染所致的肺损伤。针对RAS的其他靶点药物,如AT1R抑制剂即ARB类药物,治疗性Ang1-7肽等可通过抑制AngⅡ起到肺保护作用,是否可以"老药新用",相关疗效和安全性均需进一步实践和论证。
此外,临床工作中还亟需针对目前有争议的问题进行研究和论证。ACEI和ARB类药物对ACE2在组织中的表达及2019-nCoV易感性的影响尚无定论,相关的流行病学调查及分子水平的研究有待开展。针对COVID-19患者血压管理的争议,继续使用ACEI和ARB类药物还是换用钙通道阻滞剂?轻症患者和重症患者病程特点不同,轻症患者主要面临感染进一步扩大的风险,重症患者则面临感染后的继发损害,ACEI和ARB类药物的应用对各个群体的收益与风险分别如何?又是通过什么样的通路和机制影响疾病转归?这些问题均需大样本量的临床研究及针对性的基础研究提供证据以指导临床治疗。随着研究的深入,我们或许能将2019-nCoV、ACEI和ARB类药物与ACE2和RAS的关系理清楚,为2019-nCoV感染与血压管理的争议画上句号,同时为COVID-19的治疗提供新的思路。
利益冲突 所有作者均声明不存在利益冲突
参考文献
[1]中华人民共和国国家卫生健康委员会卫生应急办公室.2020年2月19日新型冠状病毒感染的肺炎疫情情况[EB/OL]. (2020-02-20)[2020-02-20].http://www.nhc.gov.cn/yjb/s7860/202002/4dcfcb9b74ea4a408fc1d56d4db61f93.shtml.
[2]刘培林,史蕾,顾大勇,等.人冠状病毒HCoV-HKU1研究进展[J].中国公共卫生,2017,33(8):1264-1266. DOI: 10.11847/zgggws2017-33-08-27.
[3]Matoba Y, Abiko C, Ikeda T, et al. Detection of the human coronavirus 229E, HKU1, NL63, and OC43 between 2010 and 2013 in Yamagata, Japan[J]. HYPERLINK "https://www.ncbi.nlm.nih.gov/pubmed/?term=+Detection+of+the+human+coronavirus+229E%2C+HKU1%2C+NL63%2C+and+OC43+between+2010+and+2013+in+Yamagata%2C+Japan" \o "Japanese journal of infectious diseases." Jpn J Infect Dis, 2015,68(2):138-141. DOI: 10.7883/yoken.JJID.2014.266.
[4]陈嘉源,施劲松,丘栋安,等. 2019新型冠状病毒基因组的生物信息学分析[J/OL].生物信息学,2020(2020-01-21)[2020-02-28]. http://kns.cnki.net/kcms/detail/23.1513.q.20200120.0839.002.html.[网络预发表].
[5]Tran K, Cimon K, Severn M, et al. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review[J]. PLoS One, 2012,7(4):e35797. DOI: 10.1371/journal.pone.0035797.
[6]Balakumar P, Jagadeesh G. A century old renin-angiotensin system still grows with endless possibilities: AT1 receptor signaling cascades in cardiovascular physiopathology[J]. Cell Signal, 2014,26(10):2147-2160. DOI: 10.1016/j.cellsig.2014.06.011.
[7]Tan W, Liao W, Zhou S, et al. Targeting the renin-angiotensin system as novel therapeutic strategy for pulmonary diseases[J]. Curr Opin Pharmacol, 2018,40:9-17. DOI: 10.1016/j.coph.2017.12.002.
[8]王鑫铭.血管紧张素Ⅱ2型受体及其信号对类风湿关节炎异常活化的滑膜巨噬细胞的调控作用[D].合肥:安徽医科大学, 2019.
[9]Patel VB, Zhong JC, Grant MB, et al. Role of the ACE2/angiotensin 1-7 axis of the renin-angiotensin system in heart failure[J]. Circ Res, 2016,118(8):1313-1326. DOI: 10.1161/CIRCRESAHA.116.307708.
[10]Vickers C, Hales P, Kaushik V, et al. Hydrolysis of biological peptides by human angiotensin-converting enzyme-related carboxypeptidase[J]. J Biol Chem, 2002,277(17):14838-14843. DOI: 10.1074/jbc.M200581200.
[11]Santos RA, Ferreira AJ, Verano-Braga T, et al. Angiotensin-converting enzyme 2, angiotensin-(1-7) and Mas: new players of the renin-angiotensin system[J]. J Endocrinol, 2013,216(2):R1-17. DOI: 10.1530/JOE-12-0341.
[12]Wang W, McKinnie SM, Farhan M, et al. Angiotensin-converting enzyme 2 metabolizes and partially inactivates Pyr-Apelin-13 and Apelin-17: physiological effects in the cardiovascular system[J]. Hypertension, 2016,68(2):365-377. DOI: 10.1161/HYPERTENSIONAHA.115.06892.
[13]Sodhi CP, Wohlford-Lenane C, Yamaguchi Y, et al. Attenuation of pulmonary ACE2 activity impairs inactivation of des-Arg9 bradykinin/BKB1R axis and facilitates LPS-induced neutrophil infiltration[J]. Am J Physiol Lung Cell Mol Physiol, 2018,314(1):L17-31. DOI: 10.1152/ajplung.00498.2016.
[14]Kaparianos A, Argyropoulou E. Local renin-angiotensin Ⅱ systems, angiotensin-converting enzyme and its homologue ACE2: their potential role in the pathogenesis of chronic obstructive pulmonary diseases, pulmonary hypertension and acute respiratory distress syndrome[J]. Curr Med Chem, 2011,18(23):3506-3515. DOI: 10.2174/092986711796642562.
[15]Guang C, Phillips RD, Jiang B, et al. Three key proteases--angiotensin-I-converting enzyme (ACE), ACE2 and renin--within and beyond the renin-angiotensin system[J]. Arch Cardiovasc Dis, 2012,105(6-7):373-385. DOI: 10.1016/j.acvd.2012.02.010.
[16]Alenina N, Bader M. ACE2 in brain physiology and pathophysiology: evidence from transgenic animal models[J]. Neurochem Res, 2019,44(6):1323-1329. DOI: 10.1007/s11064-018-2679-4.
[17]袁园. MERS-CoV和SARS-CoV刺突蛋白及其与受体相互作用的结构与功能研究[D].合肥:中国科学技术大学, 2017.
[18]Kuba K, Imai Y, Rao S, et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury[J]. Nat Med, 2005,11(8):875-879. DOI: 10.1038/nm1267.
[19]Nicholls J, Peiris M. Good ACE, bad ACE do battle in lung injury, SARS[J]. Nat Med, 2005,11(8):821-822. DOI: 10.1038/nm0805-821.
[20]Imai Y, Kuba K, Rao S, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure[J]. Nature, 2005,436(7047):112-116. DOI: 10.1038/nature03712.
[21]He L, Ding Y, Zhang Q, et al. Expression of elevated levels of pro-inflammatory cytokines in SARS-CoV-infected ACE2+ cells in SARS patients: relation to the acute lung injury and pathogenesis of SARS[J]. J Pathol, 2006,210(3):288-297. DOI: 10.1002/path.2067.
[22]朱应.SARS病毒感染诱导炎症基因表达的分子机制[C]//中国微生物学会病毒学专业委员会.第七届全国病毒学学术研讨会暨第二届武汉现代病毒学国际研讨会论文集,武汉,2007.
[23]吴方波,伍严安.人冠状病毒HCoV-NL63的研究进展[J].现代检验医学杂志,2012,27(3):6-9. DOI: 10.3969/j.issn.1671-7414.2012.03.002.
[24]Dijkman R, Jebbink MF, Deijs M, et al. Replication-dependent downregulation of cellular angiotensin-converting enzyme 2 protein expression by human coronavirus NL63[J]. J Gen Virol, 2012,93(Pt 9):1924-1929. DOI: 10.1099/vir.0.043919-0.
[25]Naskalska A, Dabrowska A, Szczepanski A, et al. Membrane protein of human coronavirus NL63 is responsible for interaction with the adhesion receptor[J]. J Virol, 2019,93(19):e00355-19.DOI: 10.1128/JVI.00355-19.
[26]Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J/OL]. Nature, 2020[2020-02-20]. https://www.nature.com/articles/s41586-020-2012-7.DOI:10.1038/s41586-020-2012-7. [published online ahead of print February 3, 2020].
[27]Lu R, Zhao X, Li J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding[J]. Lancet, 2020,395(10224):565-574. DOI: 10.1016/S0140-6736(20)30251-8.
[28]Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation[J/OL]. Science, 2020[2020-02-20]. https://science.sciencemag.org/content/early/2020/02/19/science.abb2507.long.DOI: 10.1126/science.abb2507. [published online ahead of print February 19, 2020].
[29]Zou X, Chen K, Zou J, et al. The single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to Wuhan 2019-nCoV infection[J/OL]. Front Med, 2020[2020-02-20].http://journal.hep.com.cn/fmd/EN/10.1007/s11684-020-0754-0. DOI: 10.1007/s11684-020-0754-0.[published online ahead of print February 8, 2020].
[30]任翊,丁惠国,吴清发,等. RT-PCR测定SARS患者粪便及漱口液中SARS CoV RNA及其临床意义[J].中华微生物学和免疫学杂志,2003,23(12):930-932. DOI: 10.3760/j:issn:0254-5101.2003.12.004.
[31]Zhao Y, Zhao Z, Wang Y, et al. Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov[DB/OL]. bioRxiv,2020(2020-01-26)[2020-02-08]. https://doi.org/10.1101/2020.01.26.919985.
[32]Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020,395(10223):497-506. DOI: 10.1016/S0140-6736(20)30183-5.
[33]中国疾病预防控制中心新型冠状病毒肺炎应急响应机制流行病学组.新型冠状病毒肺炎流行病学特征分析[J].中华流行病学杂志,2020,41(2):145-151.DOI:10.3760/cma.j.issn.0254-6450.2020.02.003.
[34]刘映霞,杨扬,张聪,等.新型冠状病毒(2019-nCoV)感染患者肺损伤相关的临床及生化指标研究[J/OL].中国科学:生命科学,2020(2020-02-12)[2020-03-08]. http://kns.cnki.net/kcms/detail/11.5840.Q.20200212.0801.006.html. DOI: 10.1360/SSV-2020-0037.[网络预发表].
[35]Holshue ML, DeBolt C, Lindquist S, et al. First case of 2019 novel coronavirus in the United States[J]. N Engl J Med, 2020,382(10):929-936. DOI: 10.1056/NEJMoa2001191.
[36]Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study[J/OL]. Lancet Respir Med, 2020[2020-02-24]. https://www.thelancet.com/journals/lanres/article/PIIS2213-2600(20)30079-5/fulltext.DOI: 10.1016/S2213-2600(20)30079-5. [published online ahead of print February 24, 2020].
[37]唐春仕,谭利辉,卢新林,等.循环miRNA-296-5p与原发性高血压发病机制的相关性研究[J].贵州医科大学学报,2017,42(3):360-364. DOI: 10.19367/j.cnki.1000-2707.2017.03.026.
[38]Ferrario CM, Jessup J, Chappell MC, et al. Effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin-converting enzyme 2[J]. Circulation, 2005,111(20):2605-2610. DOI: 10.1161/CIRCULATIONAHA.104.510461.
[39]Lei C, Fu W, Qian K, et al. Potent neutralization of 2019 novel coronavirus by recombinant ACE2-Ig[DB/OL]. bioRxiv, 2020(2020-02-01)[2020-03-08].https://doi.org/10.1101/2020.02.01.929976.
[40]Khan A, Benthin C, Zeno B, et al. A pilot clinical trial of recombinant human angiotensin-converting enzyme 2 in acute respiratory distress syndrome[J]. Crit Care, 2017,21(1):234. DOI: 10.1186/s13054-017-1823-x.
来源:中华心血管病杂志