心血管病患者感染新型冠状病毒肺炎112例临床特点及转归
心血管病患者感染新型冠状病毒肺炎112例临床特点及转归
彭昱东 孟凯 官红权 冷良 祝睿锐 王博远 何美安 程龙献 黄恺 曾秋棠
中华心血管病杂志, 2020,48:网络预发表. DOI: 10.3760/cma.j.cn112148-20200220-00105
摘要
目的 研究心血管病(CVD)患者罹患新型冠状病毒肺炎(COVID-19)后的临床特点及转归。
方法 回顾性分析2020年1月20日至2020年2月15日入武汉协和医院西院的112例COVID-19合并CVD患者,按病情严重程度分为危重组(n=16)和普通组(n=96),观察随访至临床终点。观察指标包括全血细胞计数、C反应蛋白(CRP)、动脉血气分析、心肌损伤标志物、凝血功能、肝肾功能、电解质、降钙素原(PCT)、B型利钠肽(BNP)、血脂、肺部CT及病原学检测。
结果 与普通组比较,危重组患者淋巴细胞计数[0.74×109(0.34×109,0.94×109)/L比0.99×109(0.71×109,1.29×109)/L,P=0.03]较低,CRP[106.98(81.57,135.76)mg/L比34.34(9.55,76.54)mg/L,P<0.001]和PCT[0.20(0.15,0.48)μg/L比0.11(0.06,0.20)μg/L,P<0.001]较高;危重组体重指数(BMI)明显高于普通组[25.5(23.0,27.5)kg/m2比22.0(20.0, 24.0)kg/m2,P=0.003]。112例患者中全因死亡17例(15.18%),治愈95例(84.82%)。死亡患者中,BMI>25 kg/m2患者占88.24%(15/17),明显高于治愈患者的18.95%(18/95,P<0.001)。和治愈患者比较,死亡患者血乳酸[1.70(1.30,3.00)mmol/L比1.20(1.10,1.60)mmol/L,P<0.001]较高,氧合指数[130(102,415)比434(410,444),P<0.001]明显偏低。使用ACEI/ARB的患者比例无论在危重组与普通组间还是在死亡与治愈患者间比较,差异均无统计学意义(P均>0.05)。
结论 COVID-19合并CVD病情重病死率较高。危重患者淋巴细胞偏低,危重患者和死亡患者BMI值偏高。ACEI/ARB不影响COVID-19合并CVD患者的发病率和病死率。加剧患者死亡的原因可能与炎症反应、乳酸堆积酸中毒以及恶性心血管事件有关。
引用本文: 彭昱东, 孟凯, 官红权, 等. 心血管病患者感染新型冠状病毒肺炎112例临床特点及转归 [J/OL] . 中华心血管病杂志,2020,48 (2020-03-02).http://rs.yiigle.com/yufabiao/1183314.htm. DOI: 10.3760/cma.j.cn112148-20200220-00105.[网络预发表].
参考文献导出: Endnote NoteExpress RefWorks NoteFirst 医学文献王
自2019年12月以来,新型冠状病毒肺炎(COVID-19)在中国武汉暴发。该病主要通过呼吸道飞沫或接触传播,人群普遍易感。截至2020年2月23日,全球已有78811人感染发病(其中死亡2462例) [1],防治形势异常严峻。COVID-19的主要症状是发热、乏力和干咳,大多预后良好。但COVID-19有29.3%~45.7%的患者合并心血管疾病(cardiovascular disease, CVD)[2,3,4,5,6],易迅速进展为急性呼吸窘迫综合征、感染性休克和难以纠正的代谢性酸中毒、凝血功能障碍,甚至死亡[3]。本研究总结了112例确诊COVID-19合并CVD患者的临床特点及转归,为这类患者的防治工作提供一些新的思路和启示。
连续筛选2020年1月20日至2月15日在华中科技大学同济医学院附属协和医院西院定点收治住院确诊的COVID-19患者406例,其中112例合并CVD入选本研究(占27.6%)。根据国家卫生健康委员会COVID-19的诊疗标准[7]确诊,CVD包括明确诊断的高血压、冠心病和心力衰竭。高血压诊断依据中国高血压健康管理规范(2019)[8];冠心病诊断标准:冠状动脉造影或冠状动脉CT提示至少一支心外膜主要血管直径狭窄程度>50%或有明确的陈旧性心肌梗死病史;心力衰竭诊断标准依据中国心力衰竭诊断和治疗指南2018 [9]。排除标准:年龄<18岁,全身系统性疾病和严重肝肾功能异常。
按诊疗标准进行临床分类[7]:(1)轻度:有发热、呼吸道等症状,影像学表现为肺炎;(2)重度(以下任何一条):①呼吸窘迫,呼吸频率≥30次/min;②静息状态下手指氧饱和度≤93%;③氧合指数[动脉血氧分压(PaO2)/吸氧浓度(FiO2)]≤300 mmHg (1 mmHg=0.133 kPa);(3)危重(有下列情形之一者):①呼吸衰竭需要机械通气;②休克;③合并其他器官衰竭需要重症监护病房(ICU)监护和治疗。其中轻度和重度入普通组96例,危重组16例。按初发症状至入院的时间分为:早期就诊(≤7 d);中期就诊(7~11 d);晚期就诊(>11 d)。所有治疗和出院标准按照国家卫生健康委员会诊疗标准执行[7]。本研究经华中科技大学同济医学院附属协和医院伦理委员会批准([2020]伦审字12号),并在中国临床试验注册中心注册(注册号ChiCTR2000029865)。
包括全血细胞计数、C反应蛋白(CRP)、动脉血气分析、心肌损伤标志物、凝血功能、血清生化检测(包括肾功能、肝功能、电解质、血脂),降钙素原(PCT)、B型钠肽(BNP)、肌钙蛋白I(TnI)和体重指数(body mass index,BMI)以及详细服药情况。对呼吸道标本(包括鼻咽拭子、支气管肺泡灌洗液、痰液或支气管抽吸液)进行2019-nCoV、流感、禽流感、呼吸道合胞体病毒、腺病毒、副流感病毒、SARS-CoV和MERS-CoV等病毒检测,并常规进行细菌和真菌检查。所有患者均于入院24 h内完成标本采集和肺部CT扫描。
采用SAS 9.2统计软件进行统计分析。符合正态分布的计量资料以均数±标准差表示,采用独立样本t检验;非正态分布计量资料以M(Q1,Q3)表示,采用Wilcoxon秩和检验;计数资料以例(%)表示,采用卡方检验。以P<0.05为差异统计学意义。
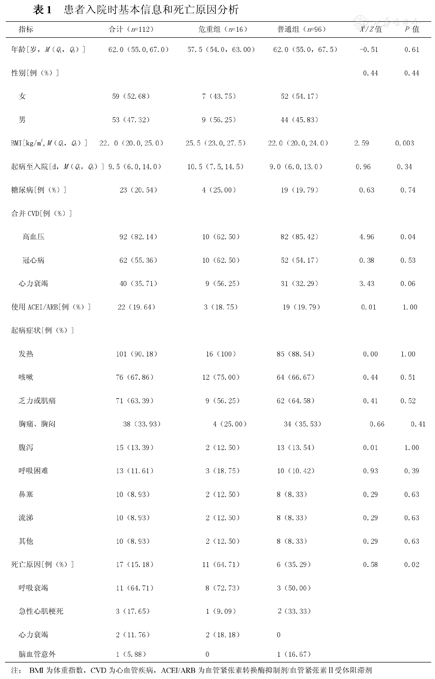
患者入院时基本信息和死亡原因分析
共入组112例患者,占我院同期确诊COVID-19患者(406例)的27.6%。所有COVID-19合并CVD患者的年龄为62.0(55.0,67.0)岁,其中男53例,女59例。普通组96例(86.7%),危重组16例(14.3%),两组患者年龄分别是62.0(55.0,67.5)和57.5(54.0,63.0)岁,差异无统计学意义(P=0.61)。危重组患者BMI明显高于普通组(P=0.003)。入院到症状出现的时间为9.5(6.0,14.0)d,两组患者院外延迟时间差异无统计学意义(P=0.34)。23例(20.54%)患者合并糖尿病,其在两组组间分布差异无统计学意义(P=0.74)。CVD中高血压最常见(82.14%),其次是冠心病和心力衰竭。CVD患者中22例(19.64%)使用血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体阻滞剂(ARB),两组患者服用ACEI/ARB比例相当(P=1.00)。大多数患者有发热、咳嗽、乏力或肌痛、胸痛、胸闷、腹泻、呼吸困难症状,鼻塞和流涕症状少见。
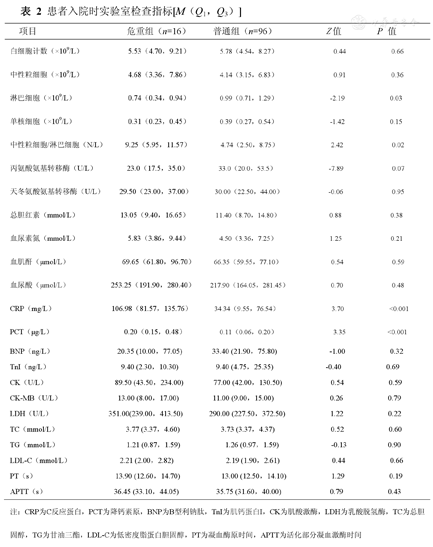
患者入院时实验室检查指标[M(Q1,Q3)]
入院时两组患者的白细胞、中性粒细胞和单核细胞计数正常,差异无统计学意义(P>0.05)。与普通组比较,危重组患者淋巴细胞明显较低(P=0.03),中性粒细胞/淋巴细胞比值(N/L)较高(P=0.02),CRP和PCT水平较高(P<0.01);但肝肾功能,BNP、心肌损伤标记物、血脂、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)等差异均无统计学意义(P均>0.05)。
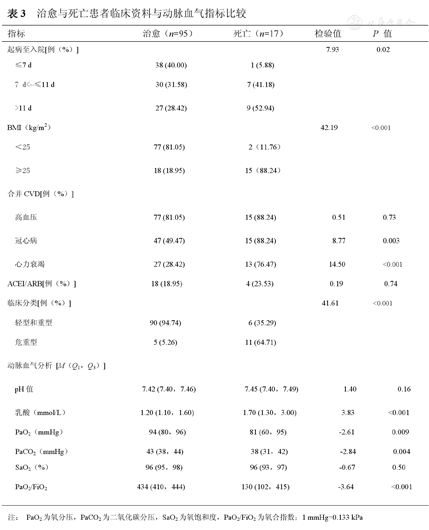
治愈与死亡患者临床资料与动脉血气指标比较
本组患者全因死亡率为15.18%(17/112),其中11例死于呼吸衰竭,3例死于急性心肌梗死(acute myocardial infarction,AMI),2例死于心力衰竭,1例死于脑血管意外;95例治愈。治愈出院患者中,38例(40.00%)为早期就诊,27例(28.42%)为晚期就诊。17例死亡病例中,仅1例(5.88%)为早期就诊,9例(52.94%)为晚期就诊;BMI>25 kg/m2者占88.24%(15/17),合并高血压、冠心病和心力衰竭者分别占88.24%(15例)、88.24%(15例)和76.47%(13例),且合并冠心病或心力衰竭患者比例明显高于治愈患者(P均<0.01)。使用ACEI/ARB的患者比例无论在危重组与普通组还是在死亡与治愈患者间比较,差异均无统计学意义(P均>0.05)。死亡病例的pH值和氧饱和度与治愈患者比较,差异无统计学意义(P>0.05),而两者的乳酸值、PaO2、氧合指数和PaCO2差异均有统计学意义(P<0.01)。
目前,COVID-19疫情仍未得到很好的控制,有关COVID-19合并CVD的研究也鲜见报道。我院收治患者中,COVID-19患者合并CVD的比例为27.6%,略低于既往的报道[4,5],且无性别差异。与COVID-19患者比较,COVID-19合并CVD的危重症比例和病死率明显升高[4,5]。糖尿病可能不是COVID-19的危险因素。此外,BMI增高的CVD患者往往病情重预后差,但临床预后与血脂水平无关,可能与患者体内过强的炎症反应相关[10],还可能与肥胖者鼾症、需氧/供氧量比例失衡有关。在所观察的3种CVD中,合并高血压最常见且在死亡与治愈人群中分布相当。虽然在普通组和危重组间,合并冠心病或心衰的患者比例无差别,但冠心病或心衰患者预后较差。除上述因素外,患者发病至入院时间越短,病死率越低。
COVID-19合并CVD患者的实验室检查有一定特点。由于2019-nCoV消耗了大量CD4+和CD8+T淋巴细胞[4],患者入院时的白细胞计数多数正常,但淋巴细胞普遍减少,N/L值可以作为临床严重程度判断的一个直观指标。2019-nCoV感染没有直接影响CVD患者肝肾功能、血脂和PT、APTT。Xu等[10]最近的尸检结果发现,COVID-19患者心肌细胞结构完整,仅细胞间质有少量单核细胞炎性浸润。本研究也发现,患者BNP、心肌损伤标记物在危重组没有明显增高,说明该病毒可能并没有实质性地损伤心肌细胞,TnI的轻度增高可能与呼吸衰竭、缺氧、休克等循环障碍相关。
危重患者中,两个炎症指标CRP和PCT均显著升高。与SARS-CoV和MERS-CoV一样,患者感染2019-nCoV后可导致Th1反应增强和相应炎性因子的释放,同时白细胞介素(IL)-4和IL-10也表达增加,这说明Th2反应也增强[2]。炎症风暴使CD4+T细胞中高度促炎的CCR4+CCR6+Th17细胞增殖,CD8+T细胞表达高浓度的细胞毒颗粒,T细胞过度活化造成更强的炎症风暴[10]。PCT是细菌感染的特异性炎症指标,其显著升高说明COVID-19合并CVD患者更容易继发细菌感染,预后差。
在CVD患者感染2019-nCoV的进程中,肾素-血管紧张素系统(RAS)的作用备受关注。循环和局部的RAS在组织分化和炎症反应,以及调节血压和维持体内液体平衡方面起重要作用[11]。ACEI/ARB和血管紧张素转换酶2(ACE2)共同参与RAS的调控。动物模型证实循环和局部组织中的ACE2对心血管系统有一定的保护作用[11]。最近的研究证实,2019-nCoV与SARS冠状病毒一样,通过病毒S-蛋白和ACE2受体结合,侵入人体呼吸道上皮细胞,这些受体80%以上表达在Ⅱ型肺泡上皮细胞和心血管内皮细胞表面[12]。因此,推测既往或正在使用ACEI/ARB的CVD患者更容易感染2019-nCoV,而且预后可能更差。但本研究中,ACEI/ARB并没有增加CVD人群的COVID-19发生率和病死率。
我们还观察到,呼吸衰竭是COVID-19患者死亡的主要原因,其次是AMI。我们推测,这类AMI有可能因严重的呼吸衰竭所继发。虽然2019-nCoV可能对心肌细胞未产生实质性损伤[10],但呼吸衰竭导致的乳酸堆积和缺氧使得冠状动脉舒缩功能异常,休克后期心肌灌注不足和血液高凝状态加速了AMI的发生。按照国际上关于AMI新的定义,我们认为部分患者属于2型心肌梗死的范畴[13]。由于普遍缺乏负压心导管室,多数患者未实施最佳的缺血-再灌注治疗(多选择就地溶栓),死亡率极高。
本次研究尚需完善。因为这是一个单中心描述性研究,而且时间仓促病例数有限,很难用多因素回归模式准确评估各项风险因素。由于观察例数少,ACEI/ARB使用是否对患病和预后有影响,尚需进一步临床观察。此外,本研究仅关注了疾病的起点和结局,缺乏疾病进展的动态观察和流行病学调查的完整性。
总之,CVD患者是COVID-19的一个特殊群体,病情重预后差,应兼顾对恶性心血管事件的防治。关于潜在的治疗方法,在积极治疗原发病的基础上,炎症因子的血液净化可能有助于改善严重COVID-19合并CVD患者的预后。此外,开发有效的抗病毒药物和疫苗刻不容缓。
利益冲突 所有作者均声明不存在利益冲突
来源:中华心血管病杂志